
Doctora en Biología Molecular por la Universidad Central de Venezuela.
Graduada en Biotecnología por la Universidad de Extremadura, BIOTECH MEDICAL SIMULATION S.L., info@biotme.com.
La inmunoterapia ha surgido como una de las estrategias más revolucionarias y prometedoras en la lucha contra el cáncer.
Este enfoque terapéutico aprovecha el propio sistema inmunológico del paciente para identificar y destruir las células cancerosas, ofreciendo una alternativa y/o un complemento a los tratamientos tradicionales, como son la quimioterapia y la radioterapia.
A medida que las investigaciones avanzan, la inmunoterapia se está posicionando como una piedra angular en el tratamiento oncológico, con el potencial de mejorar significativamente los resultados para los pacientes.
El sistema inmunológico humano es una red compleja de células, tejidos y órganos que trabajan en conjunto para defender el cuerpo contra infecciones y enfermedades. Entre sus componentes más importantes se encuentran los linfocitos T y B, las células presentadoras de antígenos, los macrófagos y las células dendríticas. En condiciones normales, este sistema puede reconocer y eliminar células anormales o infectadas.
Sin embargo, las células cancerosas a menudo desarrollan mecanismos para evadir la detección inmunológica. Pueden, por ejemplo, reducir la expresión de antígenos en su superficie, secretar factores inmunosupresores o inducir un microambiente tumoral que favorezca la tolerancia inmunológica.
La inmunoterapia representa una frontera emocionante en la oncología moderna, ofreciendo nuevas esperanzas para los pacientes con cáncer. Este enfoque terapéutico se basa en la premisa de que el sistema inmunológico, con la ayuda adecuada, puede ser un aliado poderoso en la lucha contra las células cancerosas.
Pero ¿por qué es crucial el sistema inmunológico para lograr tratamientos efectivos contra el cáncer? Es debido a que la inmunoterapia busca revertir las estrategias de evasión, potenciando las defensas naturales para reactivar la capacidad del sistema inmunológico para combatir el cáncer.
Tipos de inmunoterapia
Existen diversas modalidades de inmunoterapia que se utilizan en el tratamiento del cáncer, cada una con mecanismos de acción específicos:
Inhibidores de puntos de control inmunológico: estos fármacos bloquean las moléculas inhibidoras en la superficie de los linfocitos T, permitiendo que ahora estas células ataquen más eficazmente a las células cancerosas. Algunos ejemplos incluyen los inhibidores de PD-1 (programmed death-1) como el pembrolizumab y el nivolumab, y los inhibidores de CTLA-4 (cytotoxic T-lymphocyte-associated protein 4) como el ipilimumab.
Terapias con células T: este enfoque implica la modificación y expansión de las células T del paciente fuera del cuerpo, para luego reintroducirlas en el mismo paciente con el objetivo de atacar las células cancerosas. Un ejemplo lo constituye la terapia con células T con receptores de antígenos quiméricos (CAR-T).
Vacunas contra el cáncer: estas vacunas están diseñadas para estimular una respuesta inmunológica específica contra los antígenos asociados al tumor. A diferencia de las vacunas profilácticas tradicionales, las vacunas contra el cáncer se utilizan como tratamiento y no preventivas.
Anticuerpos monoclonales: estos anticuerpos son diseñados para unirse específicamente a antígenos presentes en las células cancerosas, marcándolas para su destrucción por el sistema inmunológico, o bloqueando señales que promueven el crecimiento tumoral.
Citocinas: las citocinas, como la interleucina-2 (IL-2) y el interferón-alfa, son proteínas que modulan la respuesta inmunológica. Se utilizan para aumentar la actividad de las células inmunitarias contra el cáncer.

Los puntos de control inmunológico son proteínas que regulan la respuesta inmunitaria, para evitar posibles daños colaterales a los tejidos normales, durante una respuesta inmune. Las células cancerosas pueden aprovecharse y explotar estos puntos de control para evitar ser atacadas por el sistema inmunológico. Los inhibidores de puntos de control inmunológico actúan bloqueando estas proteínas reguladoras, potenciando así la capacidad de las células T para destruir las células cancerosas.
– Pembrolizumab y Nivolumab
El pembrolizumab y el nivolumab son anticuerpos monoclonales inhibidores de PD-1, que han mostrado eficacia en una variedad de cánceres, incluyendo melanoma, cáncer de pulmón no microcítico, cáncer renal y linfoma de Hodgkin. Estos fármacos se unen al receptor PD-1 en las células T, bloqueando su interacción con PD-L1 y PD-L2, lo que resulta en la activación de las células T contra las células tumorales.
– Ipilimumab
El ipilimumab es un anticuerpo monoclonal inhibidor de CTLA-4, que es utilizado principalmente en el tratamiento del melanoma avanzado. Al bloquear CTLA-4, una molécula que inhibe la activación de las células T, ipilimumab aumenta la actividad de las células T contra el cáncer. Su uso, en combinación con otros inhibidores de puntos de control, como el nivolumab, ha demostrado mejorar la supervivencia en pacientes con melanoma avanzado.
Aunque los inhibidores de puntos de control inmunológico pueden ser altamente efectivos, también pueden causar efectos secundarios significativos debido a la activación del sistema inmunológico. Estos efectos pueden incluir inflamación en diversos órganos, como el colon (colitis), el hígado (hepatitis), los pulmones (neumonitis), y la glándula tiroides (tiroiditis). En estos casos, es crucial un manejo adecuado y temprano de estos efectos secundarios, que puede incluir el uso de corticosteroides y otros inmunosupresores.
La terapia con células T implica la recolección de células T del propio paciente, su modificación o expansión ex vivo, y la reintroducción de nuevo en el paciente para combatir el cáncer. Un enfoque prominente dentro de esta categoría es la terapia con células T con receptores de antígenos quiméricos (CAR-T), en la cual las células T del paciente son modificadas genéticamente para expresar un receptor específico, que reconoce y se une a antígenos presentes en las células tumorales, promoviendo la destrucción de estas.
Terapia CAR-T
Las terapias CAR-T han revolucionado el tratamiento de ciertos tipos de cáncer hematológico. Ejemplos notables incluyen:
Estas terapias han mostrado tasas de remisión impresionantes en pacientes con cánceres refractarios o en recaídas, aunque también pueden presentar efectos secundarios significativos.
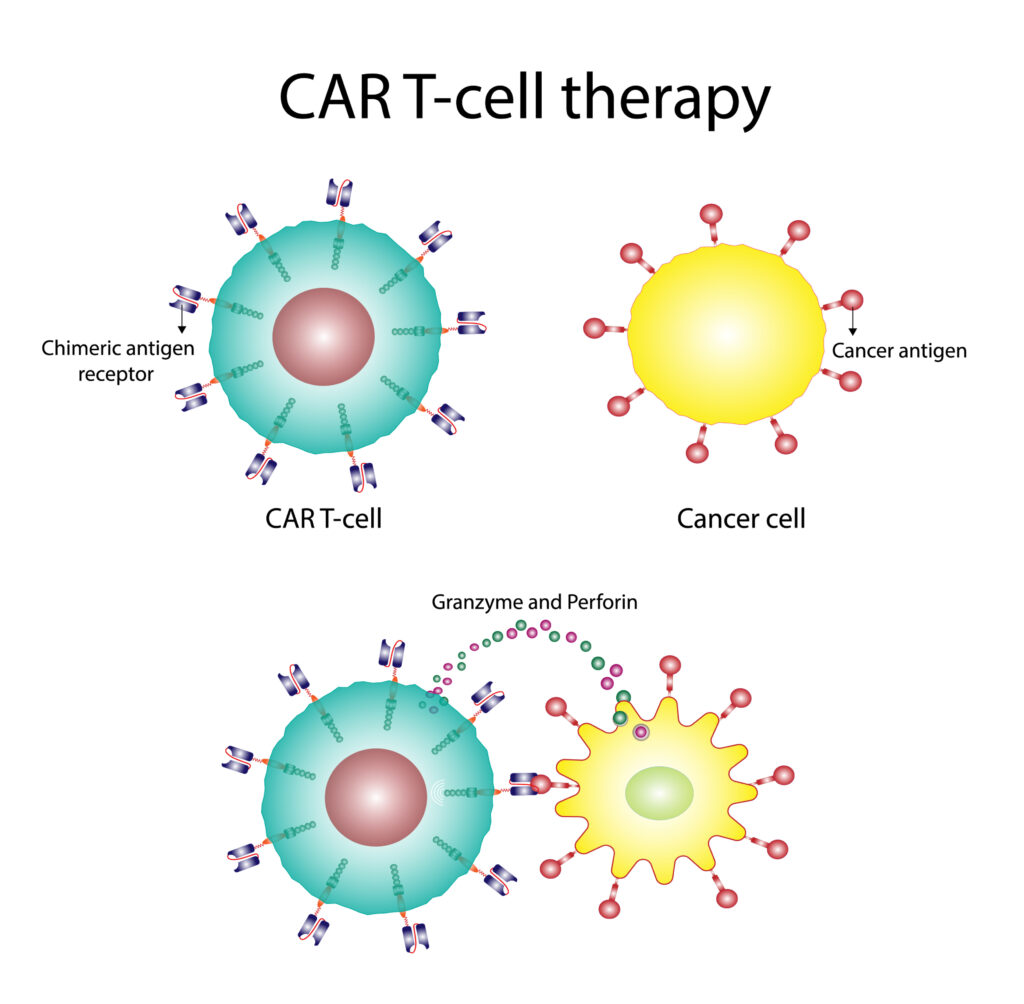
El síndrome de liberación de citoquinas es una complicación común de las terapias CAR-T, como resultado de la activación masiva de células T y la liberación de citoquinas inflamatorias. Los síntomas pueden variar desde fiebre y fatiga, hasta hipotensión severa y disfunción orgánica. El manejo del síndrome de liberación de citoquinas puede incluir el uso de tocilizumab, un anticuerpo monoclonal que bloquea el receptor de la interleucina-6, administrado junto con corticosteroides.
Las vacunas contra el cáncer están diseñadas para inducir una respuesta inmunológica específica contra los antígenos presentes en las células tumorales. Estas vacunas pueden ser profilácticas o terapéuticas. Las vacunas profilácticas, como las vacunas contra el VPH y la hepatitis B, previenen infecciones virales que pueden conducir al cáncer. Las vacunas terapéuticas, por otro lado, están diseñadas para tratar el cáncer existente, estimulando una respuesta inmunológica dirigida contra las células tumorales.
Sipuleucel-T
Sipuleucel-T (Provenge) es una vacuna terapéutica aprobada para el tratamiento del cáncer de próstata metastásico resistente a la castración. Esta vacuna se elabora a partir de las células dendríticas del paciente, las cuales son expuestas a un antígeno específico del cáncer de próstata y a una proteína inmunoestimuladora. Una vez reintroducidas en el paciente, estas células dendríticas activan una respuesta inmunológica contra las células tumorales.
Vacunas personalizadas
La investigación relativa a las vacunas personalizadas está en auge, con enfoques que incluyen la secuenciación de parte del genoma del tumor del paciente, para identificar mutaciones específicas, y desarrollar vacunas que dirijan la respuesta inmunológica contra esas mutaciones. Aunque aún en etapas experimentales, estas vacunas personalizadas podrían ofrecer tratamientos altamente específicos y efectivos para diversos tipos de cáncer.
Las vacunas contra el cáncer generalmente tienen un perfil de seguridad favorable, con efectos secundarios que suelen ser leves y transitorios, como fiebre, fatiga y reacciones en el sitio de la inyección. Sin embargo, al igual que con cualquier intervención médica, es importante monitorear y manejar cualquier efecto adverso que pueda surgir.
Los anticuerpos monoclonales son proteínas diseñadas en el laboratorio, que pueden unirse específicamente a antígenos presentes en las células cancerosas. Al unirse a estos antígenos, los anticuerpos monoclonales pueden:
Rituximab
Rituximab (Rituxan) es un anticuerpo monoclonal dirigido contra CD20, una proteína presente en la superficie de las células B. Es utilizado en el tratamiento de linfomas de células B y leucemia linfocítica crónica (LLC). Rituximab puede destruir las células B a través de varios mecanismos, incluyendo la citotoxicidad mediada por células dependiente de anticuerpos (ADCC), y la lisis mediada por complemento.
Trastuzumab
Trastuzumab (Herceptin) es un anticuerpo monoclonal dirigido contra HER2/neu, una proteína que se encuentra sobre expresada en algunos tipos de cáncer de mama y de cáncer gástrico. El anticuerpo trastuzumab bloquea las señales de crecimiento celular al unirse a HER2, y marca a las células tumorales para su destrucción por el sistema inmunológico. La combinación de trastuzumab con quimioterapia ha mejorado significativamente los resultados en pacientes con cáncer de mama HER2 positivo.
Los efectos secundarios de los anticuerpos monoclonales varían según el objetivo del anticuerpo y el tipo de cáncer tratado. Pueden incluir reacciones infusionas, toxicidad cardíaca (en el caso de trastuzumab) y supresión inmunológica (en el caso de rituximab). Es fundamental un monitoreo cuidadoso y un manejo adecuado de estos efectos secundarios, para garantizar la seguridad y eficacia del tratamiento.
Las citocinas son proteínas que modulan la actividad del sistema inmunológico. En el tratamiento del cáncer, las citocinas como la interleucina-2 (IL-2) y el interferón-alfa (IFN-α) se utilizan para aumentar la actividad de las células inmunitarias en su lucha en contra de las células cancerosas. Estas citocinas pueden estimular la proliferación y activación de linfocitos T y de células NK, mejorando la capacidad del sistema inmunológico para combatir el cáncer.
Interleucina-2 (IL-2)
La IL-2 es una citocina que promueve la proliferación y activación de las células T y las células NK. Se utiliza en el tratamiento de melanoma avanzado y de carcinoma renal metastásico. Aunque puede inducir respuestas duraderas en algunos pacientes, la IL-2 también puede causar efectos secundarios significativos, como hipotensión severa y síndrome de fuga capilar.
Interferón-alfa (IFN-α)
El IFN-α es una citocina que tiene efectos antivirales, anti proliferativos e inmunomoduladores. Se utiliza en el tratamiento de melanoma, de leucemia de células pilosas y de linfoma cutáneo de células T. Los efectos secundarios del IFN-α pueden incluir síntomas gripales, fatiga y depresión, lo que puede limitar su uso en algunos pacientes.
Las citocinas pueden causar efectos secundarios significativos debido a su potente actividad inmunomoduladora. Es crucial un manejo adecuado y monitoreo de estos efectos secundarios, tanto para maximizar los beneficios terapéuticos como para minimizar los riesgos. Es recomendable el uso de dosis escalonadas y así como el manejo sintomático de los efectos secundarios, lo cual puede ayudar a mejorar la tolerabilidad de estos tratamientos.
La inmunoterapia ha transformado el panorama del tratamiento del cáncer, ofreciendo nuevas esperanzas y opciones terapéuticas para los pacientes. Cada modalidad de inmunoterapia aporta sus propios mecanismos y beneficios únicos, pasando desde los inhibidores de los puntos de control inmunológico, hasta las diversas terapias con células T, las vacunas contra el cáncer, los anticuerpos monoclonales y el uso de las citocinas.
A medida que las investigaciones continúan avanzando, es probable que veamos una expansión aún mayor de las aplicaciones de la inmunoterapia, mejorando los resultados para los pacientes y acercándonos cada vez más a la erradicación del cáncer.
Chen, D. S., & Mellman, I. (2017). Elements of cancer immunity and the cancer–immune set point. Nature, 541(7637), 321-330. https://doi.org/10.1038/nature21349
June, C. H., & Sadelain, M. (2018). Chimeric antigen receptor therapy. New England Journal of Medicine, 379(1), 64-73. https://doi.org/10.1056/NEJMra1706169
Lin, M. J., Svensson-Arvelund, J., Lubitz, G. S., Marabelle, A., Melero, I., Brown, B. D., & Brody, J. D. (2022). Cancer vaccines: the next immunotherapy frontier. Nature cancer, 3(8), 911–926. https://doi.org/10.1038/s43018-022-00418-6
Märkl, F., Huynh, D., Endres, S., & Kobold, S. (2022). Utilizing chemokines in cancer immunotherapy. Trends in cancer, 8(8), 670–682. https://doi.org/10.1016/j.trecan.2022.04.001
Oliveira, G., & Wu, C. J. (2023). Dynamics and specificities of T cells in cancer immunotherapy. Nature reviews. Cancer, 23(5), 295–316. https://doi.org/10.1038/s41568-023-00560-y
Palucka, K., & Banchereau, J. (2013). Dendritic-cell-based therapeutic cancer vaccines. Immunity, 39(1), 38-48. https://doi.org/10.1016/j.immuni.2013.07.004
Pardoll, D. M. (2012). The blockade of immune checkpoints in cancer immunotherapy. Nature Reviews Cancer, 12(4), 252-264. https://doi.org/10.1038/nrc3239
Rosenberg, S. A., & Restifo, N. P. (2015). Adoptive cell transfer as personalized immunotherapy for human cancer. Science, 348(6230), 62-68. https://doi.org/10.1126/science.aaa4967
Topalian, S. L., Drake, C. G., & Pardoll, D. M. (2015). Immune checkpoint blockade: a common denominator approach to cancer therapy. Cancer Cell, 27(4), 450-461. https://doi.org/10.1016/j.ccell.2015.03.001

SIMULADORES ANATÓMICOS DE ENTRENAMIENTO MÉDICO
BIOTECH MEDICAL SIMULATION S.L.
De lunes a jueves:
9.00 – 14.00 h / 16.00 – 19.00 h
Viernes:
8.00 – 15.00 h
( GMT +2)
© BIOTECH MEDICAL SIMULATION S.L. Todos los derechos reservados.